
时间:2022-06-17 12:01:01来源:网络整理
1.将二氧化碳气体倒入澄清的石灰水中(复分解反应)
Ca(OH)2+CO2=CaCO3↓+H2O
现象:石灰水由清变浑。
相关知识点:该反应可用于检测二氧化碳气体的存在。
2.镁带在空气中燃烧(复合反应)
2Mg+O2=2MgO
现象:镁在空气中剧烈燃烧,发热,发出耀眼的白光,并产生白色粉末。
相关知识点:
(1)在这个反应中,镁从游离态转变为结合态;
(2)物质的颜色由银色变为白色;
(3)镁可以用作照明弹;
(4)镁条着火点高,火柴放热少,达不到镁的着火点,用火柴点燃不了;抛光干净。
3.水被电分解(分解反应)
2H2O=2H2↑+O2↑
现象:通电后,出现气泡时,气体体积比约为1:2
相关知识点:
(1)正极产生氧气,负极产生氢气;
(2)氢气和氧气的体积比为2:1,质量比为1:8;
(3)电解水时,提前在水中加入少量氢氧化钠溶液或稀硫酸,以增强水的导电性;
(4)电源是直流电。
4.生石灰与水的反应(复合反应)
CaO+H2O=Ca(OH)2
现象:白色粉末溶解
相关知识点:
(1)最后得到的溶液称为氢氧化钙溶液,俗称清石灰水;
(2)往里面滴无色酚酞,酚酞会变红;
(3)生石灰是氧化钙,熟石灰是氢氧化钙;
(4) 会散发出大量热量。
5.实验室自制吸氧
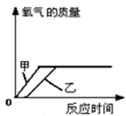
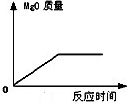
①加热氯酸钾和二氧化锰的混合物产生氧气(分解反应)
2KClO3=MnO2(作为催化剂)=2KCl+3O2↑
相关知识点:
(1)二氧化锰作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;
(2)二氧化锰的质量和化学性质在化学反应前后没有变化;
(3)反应完成后,试管内残留固体为氯化钾和二氧化锰的混合物,分离方法为:洗涤、干燥、称重。
②加热高锰酸钾产生氧气(分解反应)
2KMnO4=K2MnO4+MnO2+O2↑
相关知识点:试管口用棉花堵住,防止高锰酸钾粉滑落堵塞导管。
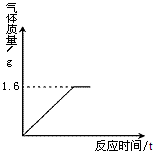
③过氧化氢和二氧化锰制氧(分解反应)
2H2O2=MnO2(作为催化剂)=2H2O+O2↑
常见知识点:
(1)向上排气法收集空气时,导管应伸到集气瓶下方,收集后应放在桌面上;水箱中的水会流动回弹试管;
(3)加热时试管应略微向下倾斜,以免冷凝水倒流而爆裂试管;
(4)使用引流采用集气法收集氧气,待气泡连续均匀冒出后再收集;.
6.木炭在空气中燃烧(复合反应)
完全燃烧:C+O2=CO2
燃烧不足:2C+O2 =2CO
现象:
它在空气中发出红光;
它在氧气中发出白光,放热氢氧化锰颜色,产生一种浑浊,使清澈的石灰水变成浑浊的无色气体。
相关知识点:反应后的产物可用澄清石灰水进行测试。
7.硫在空气(或氧气)中燃烧(复合反应)
S+O2=SO2
现象:在空气中发出淡淡的淡蓝色火焰,在氧气中发出明亮的蓝紫色火焰,产生无色刺激性气体。
相关知识点:
(1)反应后的产物可以用紫色石蕊试(紫色变红色);
( 2)提前在集气瓶底部加入少量水或碱溶液(NaOH),吸收产生的二氧化硫,防止空气污染。
8.铁丝在氧气中燃烧(复合反应)
3Fe+2O2=Fe3O4
现象:铁丝在氧气中剧烈燃烧,火花辐射,放出热量,形成黑色固体
相关知识点:
(1)导线盘绕增加与氧气的接触面积;
(2)在电线下挂一根点燃的火柴,用来点燃电线;
(3)等火柴在气瓶里烧完,太早了,火柴会消耗氧气,线不能完全燃烧;太晚了,打不着火;
(4)提前在集气瓶底部放少量细沙,防止热品飞溅爆瓶底。
9.红磷在氧气中燃烧(复合反应)
4P+5O2=2P2O5
现象:产生大量白烟并放出热量。
相关知识点:红磷可用于空气中氧含量的测定。
10.氢气在空气中燃烧(复合反应)
2H2+O2=2H2O
现象:产生淡蓝色火焰,放热,形成水滴
相关知识点:
(1)氢气是一种常见的还原剂;
(2)点火前一定要检查纯度。
11.氧化铜的炭还原(置换反应)
C+2CuO =2Cu+CO2↑
现象:黑色粉末逐渐变成鲜红色物质,放热
相关知识点:
(1)将木炭粉和氧化铜放入试管中,使加热面积大,反应快;p>(3)酒精灯加网罩集中火焰,提高温度;
(4)先将气道抽回,防止石灰水倒流而爆裂试管;
(5)试管冷却后倒出粉末,防止热铜的氧气反应生成CuO;
(6)C是还原剂,CuO是氧化剂。
12.氧化铜的氢还原(置换反应)
H2+CuO=Cu+H2O
现象:黑色粉末逐渐变成鲜红色物质,在试管口形成水滴。
相关知识点:
(1)实验开始时,应通入氢气一段时间,将试管内的空气赶出;
(2)实验结束后,应先拆酒精灯,再拆氢气导管。目的是防止新形成的铜与空气中的氧气结合形成铜氧化物。
13.二氧化碳气体的实验室制备(复分解反应)
大理石(石灰石)与稀盐酸的反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
现象:白色固体溶解,同时产生大量气泡。
相关知识点:
(1)碳酸钙是一种白色不溶性碳酸钙,混入某种物质中,利用其溶于盐酸的特性,可用盐酸去除;
(2)浓盐酸不能用,因为它有挥发性。不能用稀硫酸,因为碳酸钙与硫酸反应,生成CaSO4微溶于水,覆盖在固体表面停止反应;
(4)碳酸钙粉不能用,因为反应物接触面积大,反应速度太快。
14.工业生产二氧化碳气体(分解反应)
高温煅烧石灰石
CaCO3=CaO+CO2↑
相关知识点:CaO俗称生石灰
15.一氧化碳在空气中燃烧(复合反应)
2CO+O2=2CO2
现象:蓝色火焰
相关知识点:
(1)一氧化碳是一种常见的还原剂;
(2)点火前一定要检查纯度。
16.一氧化碳还原二氧化碳
CO+CuO=Cu+CO2
现象:黑色粉末逐渐变成鲜红色粉末,产生的气体使石灰水变浑浊
相关知识点:一氧化碳是还原剂,氧化铜是氧化剂
17.甲烷在空气中燃烧
CH4+2O2=CO2+2H2O
现象:火焰明亮而淡蓝色
相关知识点:甲烷是天然气(或沼气)的主要成分,是一种非常好的燃料。
18.工业生产盐酸(组合反应)
H2+Cl2=2HCl
相关知识点:反应描述特殊条件下不需要燃烧需要氧气。
19.实验室制氢(置换反应)
Zn+H2SO4=ZnSO4+H2↑
相关知识点:
p>
(1)氢气是一种常见的还原剂;
(2)点火前一定要检查纯度。
20.木炭和二氧化碳生成一氧化碳(复合反应)
C+CO2=2CO
相关知识点:
(1)@ >一氧化碳是一种常见的还原剂;
(2)点火前一定要检查纯度。
21.水和二氧化碳形成碳酸(复合反应)
CO2+H2O=H2CO3
现象:碳酸使紫色石蕊溶液变成红色。
22.碳酸的不稳定分解(分解反应)
H2CO3=H2O+CO2↑
相关知识点:
(1)石炭酸是一种不稳定的酸,受热容易分解;
(2)分解时氢氧化锰颜色,二氧化碳从溶液中逸出,使红色石蕊溶液呈紫色。
2 3.灭火器的反应原理
Al2(SO4)3+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
灭火原理:灭火时可喷出大量二氧化碳和泡沫,附着在可燃物上,使可燃物与空气隔绝,达到灭火的目的。
24.金属与水的反应(置换反应)
①2K+2H2O=KOH+H2↑
②3Fe+4H2O=Fe3O4+4H2↑
25.水与非金属的反应(置换反应)
C+H2O=CO+H2↑
26.水与氧化物的反应(复合反应)
①SO3+H2O=H2SO4
②Na2O+H2O=2NaOH
27.碳酸氢铵被热分解(分解反应)
NH4HCO3= NH3↑+H2O+CO2↑
28.用盐酸除锈(复分解)
Fe2O3+6HCl=2FeCl3+3H2O
29.将铁丝插入硫酸铜溶液中(置换反应)
Fe+CuSO4=FeSO4+Cu
现象:溶液由蓝色变为浅绿色,铁表面出现红色固体
30.硫酸铜溶液滴加氢氧化钠溶液(复分解反应)
CuSO4 +2NaOH=Cu(OH)2↓+Na2SO4
现象:产生蓝色沉淀
31.二氧化硫与烧碱反应
SO2 +2NaOH=Na2SO3+H2O
32.点燃酒精
C2H5OH+2O2=2CO2+3H2O
33.氯化钠溶液与硝酸银溶液反应生成不溶性沉淀(复分解反应)
NaCl+AgNO3=NaNO3+AgCl↓
34.稀硫酸溶液与硝酸钡溶液反应生成不溶性沉淀
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
35.氯化铵固体和氢氧化钙固体混合加热(复分解反应)
2NH4Cl+Ca(OH)2=2NH3↑+2H2O+CaCl2
36.碳酸钠与盐酸反应(复分解反应)
Na2CO3+HCl=NaCl+CO2+H2O
现象:固体溶解并产生气泡。
声明:文章仅代表原作者观点,不代表本站立场;如有侵权、违规,可直接反馈本站,我们将会作修改或删除处理。
图文推荐

2022-06-17 12:00:53
2022-06-17 11:01:21

2022-06-17 10:58:00

2022-06-17 10:26:19

2022-06-17 09:58:00

2022-06-17 08:58:03
热点排行
精彩文章

2022-06-17 10:58:01

2022-06-17 09:58:03

2022-06-17 09:01:54

2022-06-17 08:58:04

2022-06-16 18:58:01
2022-06-16 18:01:16
热门推荐
